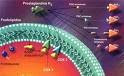
Insulin signaling is required for insulin’s direct and indirect action on hepatic glucose production
Simon J. Fisher and C. Ronald Kahn.
Simon J. Fisher and C. Ronald Kahn.
La principal acción de la insulina es inhibir la liberación de glucosa desde el hígado y estimular la recaptación tisular para remover el exceso de glucosa circulante. La Resistencia a la insulina es la disminución de la respuesta de los tejidos blanco, sobre todo hígado y músculo, a los efectos biológicos de la insulina. El organismo compensa la resistencia a la insulina mediante la secreción crónica de grandes cantidades de insulina. Esta adaptación, si bien es útil para prevenir la hiperglucemia, induce hiperinsulinemia crónica. El hígado tiene un papel primordial en la regulación de la producción endógena de glucosa a través gluconeogenesis y glucogenolisis. El incremento en la producción hepática de glucosa es principal responsable de la hiperglucemia en pacientes diabeticos. En el tratamiento con insulina sus efectos metabólicos son: reducción glucemia basal y postprandial, supresión de liberación hepática de glucosa, estimulación utilización periférica de la glucosa. . El estudio es de a traves de la aplicación de la insulina y después de un tiempo evaluar los niveles de glucosa, insulina, glucagon, y FFAs. El antagonismo con el glucagon puede tener un papel benefico y seguro como enfoque terapeutico en individuos diabeticos selectos.
Los tratamientos farmacológicos actuales para la diabetes incluyen la estimulación de la secreción de insulina, la inhibición de la producción endógena de glucosa y el aumento en la sensibilidad a las acciones de la insulina, ya que es necesario el uso de terapias mas eficaces con descubrimientos moleculares para entender la interacción entre el metabolismo de los ácidos grasos y los carbohidratos, por lo cual regular y controlar las vías bioquímicas gluconeogenicas y glucógenolíticas. Los objetivos moleculares son dirigidos a varias enzimas expresadas por genes que regulan el control de las vías gluconeogenicas y glucógenolíticas (principalmente inhibidores de la fosforilasa hepática de glucogeno e inhibidores de la glucosa-6- foasfatasa). Es por esta razón que al conocer la investigación científica (efectuada en roedores transgenicos y de knockout genético) cuales son las vías endocrinomoleculares apropiadas nos conduce con mayor presicion al desarrollo de fármacos con mecanismos moleculares definidos y específicos.
Structural specificity for prostaglandin effects on hepatocyte glycogenolysis.
E P Brass and M J Garrity.
Las prostaglandinas derivan de ácidos grasos monocarboxílicos insaturados de 20 carbonos, los cuales están formados por dos cadenas y un anillo de cinco carbonos.Las diferentes prostaglandinas se diferencian solamente por pequeños cambios en la metilación u oxidación de sus cadenas carbonadas. En el hombre, el precursor más importante de las prostaglandinas es el ácido araquidónico.
La acción de las prostaglandinas está relacionada con cambios en el AMP cíclico; en unos sistemas la misma prostaglandina es capaz de estimular la adenilciclasa, caso en el cual estimula la función celular y en otros es capaz de inhibirla, manifestándose por depresión de sus funciones. La intensidad de acción de diferentes prostaglandinas sobre la adenil ciclasa no es igual. Las PGI2 y el tromboxano TXA2 tienen un efecto más potente sobre el AMP y el GMP cíclicos que las PGEs. Existe evidencia que la PGI1 es la sustancia natural que se une con más avidez al receptor. El glucagon eleva la glucemia al estimular la adenilciclasa en las celulas hepaticas. Su secrecion es mediada por receptores adrenergicos y AMP ciclico.
Las prostaglandinas tienen efecto en el metabolismo hepático de la glucosa. Las PGE fueron encontradas en la estimulación de la producción de glucosa hepatica. Los efectos de las prostalandinas sobre los hepatocitos, es la estimulacion de glucogenolis y AMPc. Las prostaglandinas regulan el metabolismo de la glucosa y los lipidos en los hepatocitos que tienen una capacidad de biosíntesis de prostaglandinas.
The pharmacology and toxicology of "ecstasy" (MDMA) and related drugs
Harold Kalan.
El ecstasy es el nombre común de la droga que contiene 3,4-methylenedioxymethanphetamine (MDMA), además puede contener otras drogas que son también phenethylamines, que incluye anfetaminas como son: 3,4-methylenedioxyethylamphetamine (MDEA), 3,4-methylenedioxyamphetamine (MDA) y N-methyl-1-(3,4-methylenedioxyphenil)-2-butanamine (MBDB).
El MDMA componente activo del ecstasy primero fue sintetizado por la compañía Merck en 1912 y fue patentado en 1914, esto no fue comercializado. Pero después en 1950 el MDMA fue estudiado por el ejército de Estados Unidos como un agente psicológico, pero no se hizo un estudio muy profundo. En 1965 Alexander Shulgin sintetizo MDMA en su laboratorio, y en 1970 fue usado en la psicoterapia como una droga para el alma. Hasta en1977 el MDMA es ilegal en UK y en 1985 en USA, por ser un agente toxico. Durante 1987-1988 se propago el uso del ecstasy durante festivales de música al aire libre o en casas y clubes privados nocturnos. A partir de los 90 aparece cada vez con mayor fuerza en Europa propagándose por todo el mundo.
El ecstasy y la mezcla de este con el baile, música por lo general electrónica de sonidos fuertes tiene numerosos efectos físicos, psicológicos, emocionales que alteran el normal funcionamiento del individuo, muchas veces causándole la muerte. Inicialmente se experimenta una sensación de euforia y bienestar aunque un pequeño porcentaje de personas presentan turbación, ansiedad o tensión, confusión, depresión, problemas para dormir, deseo vehemente por consumir la droga, y ansiedad severa.
Otros efectos físicos son: Taquicardia, arritmia e hipertensión, pérdida del apetito, sequedad de boca, sudoración, deshidratación, hipertermia, sobrestimulación (aumento del estado de alerta, insomnio), náuseas, vómitos, temblores, hiperactividad motora, escalofríos y deshidratación severa; pueden experimentarse problemas cardiacos o una insuficiencia renal aguda, que podrían provocar la muerte.
MDMA puede interferir con la habilidad del cuerpo para regular la temperatura.los sujetos se hallaban en fiestas multitudinarias y lugares cerrados, donde la ingestión de MDMA, la sostenida actividad física, la alta temperatura ambiental y la falta de líquido debieron alterar su mecanismo termorregulador (hipertemia). Esto puede llevar a un aumento drástico en la temperatura corporal entre 40º-43ºC, debido a una concentración de 4.2 mg/l de MDMA y valores semejantes de MDEA y a que se baila durante horas, hay deshidratación, y la falsa sensación de fuerza anula los mecanismos de alarma del organismo, la euforia hace pensar que todo es posible, alterándose el sistema termorregulador y la temperatura corporal se dispara hasta que se da un fallo progresivo en los distintos órganos que puede ser mortal.
En muchos casos el consumo de ecstasy es mezclado con el alcohol o con heroína u otras drogas que producen efectos fatales como convulsiones, arritmias cardiacas, insuficiencia renal, hemorragia cerebral, e infarto. Además se presentan casos de daños en el hígado, hepatitis, y rabdomiolisis que es la descomposición de las fibras musculares que ocasiona la liberación de los contenidos de dichas fibras en la circulación y algunas de éstas son tóxicas para el riñón y con frecuencia causan daño renal.
El MDMA causa numerosos problemas neurológicos y psiquiátricos, ya que afecta los neurotransmisores la serotonina, noradrenalina y la dopamina. El sistema de la serotonina juega un papel importante en la regulación del estado de ánimo, la agresión, la actividad sexual, el sueño, y la sensibilidad al dolor. Se altera la percepción del tiempo y la capacidad de concentración y coordinación, pudiendo presentarse crisis de ansiedad y ataques de pánico, alteraciones de la memoria hasta trastornos afectivos y psicosis paranoide, depresión, alucinaciones. Daños en las neuronas que contienen dopamina, es la causa de las fallas motoras que se observan en los pacientes que padecen el mal de Parkinson. Los síntomas de esta enfermedad comienzan con la falta de coordinación y temblores, y podrían resultar en un tipo de parálisis. Esta a largo plazo puede producir diversas enfermedades cerebrales tales como Alzheimer, Parkinson y de más relacionadas con perdida de neuronas o neurotrasmisores.
Además el ecstasy tiene una gran neurotoxicidad que se demuestra con Las investigaciones en los animales vinculando la exposición a la MDMA con daño a largo plazo a las neuronas involucradas en el estado de ánimo, el pensamiento y el juicio. Estas investigaciones demuestran las propiedades dañinas del MDMA sugieren que no es una droga segura para el consumo humano.
Así el ecstasy es una droga con múltiples efectos negativos y mortales para el individuo, gran neurotoxicidad, no debe ser consumida. Esta droga es ilegal pero su comercialización es callejera o en clubes privados nocturnos, asociados con fiestas donde se mezcla otras drogas generándose mayor riesgo de muerte y menor control del consumo.
Amphetamine-induced loss of human dopamine transporter activity: An internalization-dependent and cocaine-sensitive mechanism.
la dopamina, una molécula que se forma por descarboxilación metabólica del aminoácido no proteínico L-dopa (dihidroxifenilalanina). El transportador de Dopamina humano (DAT) es un miembro de la familia de los transportadores dependientes de NA+ y CL- y modula la captación sináptica de la Dopamina en la neurona Dopaminergica, a través de un mecanismo electrogenico. La Dopamina y bloqueadores característicos de la recaptura presináptica de ella, como cocaína, se unen tanto a dominios iguales como distintos del transportador, lo que es fuertemente influenciado por la presencia de cationes en el medio. La recaptación de Dopamina libre de la sinápsis es el principal mecanismo de modulación de función dopaminérgica, y es bloqueada por neurotóxicos como la cocaína. Esto explica el efecto estimulador dopaminergico de esta droga.
La acción directa de la cocaína, sobre la recaptacion de dopamina en las terminaciones nerviosas, aumenta la acción de este neurotransmisor en la sipnasis, por la activación de receptores que pueden modular la liberación de dopamina. Los subtipos conocidos de receptores de dopamina forman parte de la familia de receptores ligados a la proteína G con un terminal amino N extracelular y un terminal carboxilo C intracelular. Uno de los sistemas neurales que parece ser más afectado por la cocaína se origina en una región muy profunda del cerebro llamada el área ventral del tegmento (AVT). Las neuronas del AVT aumentan considerablemente la cantidad de dopamina que liberan cuando hay presencia de cocaína. La cocaína bloquea la eliminación de la dopamina de la sinapsis lo que resulta en una acumulación de la misma. Esta acumulación de dopamina causa una estimulación continua de las neuronas receptoras, lo que se asocia con la euforia que reportan los usuarios de cocaína.
Se ha demostrado que la cocaína, la anfetaminas incrementan la transmisión dopaminergica en áreas cerebrales afectando los niveles de dopamina, las anfetaminas tienen un efecto similar en la recaptura de monoaminas al de la cocaína y además incrementa la liberación y síntesis de dopamina. Las anfetaminas también pueden inhibir el catabolismo de la dopamina por el bloqueo de la enzima monoamino oxidasa.
Así el estudio de la dopamina y su transporte permite avanzar en la comprensión de la función de los sistemas dopaminergicos y así diseñar estrategias terapéuticas para estados patologicos relacionados.
La acción directa de la cocaína, sobre la recaptacion de dopamina en las terminaciones nerviosas, aumenta la acción de este neurotransmisor en la sipnasis, por la activación de receptores que pueden modular la liberación de dopamina. Los subtipos conocidos de receptores de dopamina forman parte de la familia de receptores ligados a la proteína G con un terminal amino N extracelular y un terminal carboxilo C intracelular. Uno de los sistemas neurales que parece ser más afectado por la cocaína se origina en una región muy profunda del cerebro llamada el área ventral del tegmento (AVT). Las neuronas del AVT aumentan considerablemente la cantidad de dopamina que liberan cuando hay presencia de cocaína. La cocaína bloquea la eliminación de la dopamina de la sinapsis lo que resulta en una acumulación de la misma. Esta acumulación de dopamina causa una estimulación continua de las neuronas receptoras, lo que se asocia con la euforia que reportan los usuarios de cocaína.
Se ha demostrado que la cocaína, la anfetaminas incrementan la transmisión dopaminergica en áreas cerebrales afectando los niveles de dopamina, las anfetaminas tienen un efecto similar en la recaptura de monoaminas al de la cocaína y además incrementa la liberación y síntesis de dopamina. Las anfetaminas también pueden inhibir el catabolismo de la dopamina por el bloqueo de la enzima monoamino oxidasa.
Así el estudio de la dopamina y su transporte permite avanzar en la comprensión de la función de los sistemas dopaminergicos y así diseñar estrategias terapéuticas para estados patologicos relacionados.